კაპილარული ელექტროფორეზის შესახებ
სანგერის სექვენირება წარმოადგენს დნმ-ის სექვენირების მეთოდს, რომლის კომერციალიზაცია პირველად კომპანია Applied Biosystems-ის მიერ განხორციელდა. მეთოდის პრინციპი მდგომარეობს დნმ-ის მოლეკულის in-vitro პირობებში რეპლიკაციისას სინთეზირებად ჯაჭვში ტერმინალური დიდეოქსინუკლეოტიდების ჩართვაში ფერმენტ დნმ-პოლიმერაზას მიერ. მეთოდი შემუშავებულ იქნა ფრედერიკ სანგერის და მისი სამეცნიერო ჯგუფის მიერ 1977 წელს.
სანგერის სექვენირება ყველაზე ფართოდ გამოყენებადი სექვენირების მეთოდს წარმოადგენდა დაახლოებით 40 წლის განმავლობაში. დღესდღეობით სექვენირების უახლეს მეთოდს ახალი (შემდეგი) თაობის სექვენირება (Nexr Generation Sequencing - NGS) წარმოადგენს, რომელიც გამოიყენება უფრო ფართო მასშტაბის გენომური ექსპერიმენტებისთვის. მიუხედავად ახალი მეთოდოლოგიის შემუშავებისა, სანგერის მეთოდი კვლავაც ინარჩუნებს აქტუალობას და ფართოდ გამოიყენება შედარებით მცირე ზომის გენეტიკური მონაკვეთების ანალიზისთვის, ასევე NGS-ის შედეგების ვალიდაციისა და გრძელი დნმ-რიდების (500-ზე მეტი ნუკლეოტიდი) სექვენირებისთვის.
მეთოდის შესახებ
სექვენირების კლასიკური ჯაჭვის-ტერმინაციის მეთოდი სარეაქციო არეში საჭიროებს ერთჯაჭვიან დნმ-მატრიცას, დნმ-პრაიმერს, დნმ-პოლიმერაზას, დეოქსინუკლეოზიდტრიფოსფატებს (dNTPs) და მოდიფიცირებულ დი-დეოქსინუკლეოტიდტრიფოსფატებს (ddNTPs). ეს უკანასკნელი კომპონენტი (ddNTPs) განაპირობებს დნმ-ის ჯაჭვის ელონგაციის (დაგრძელების) ტერმინაციას.
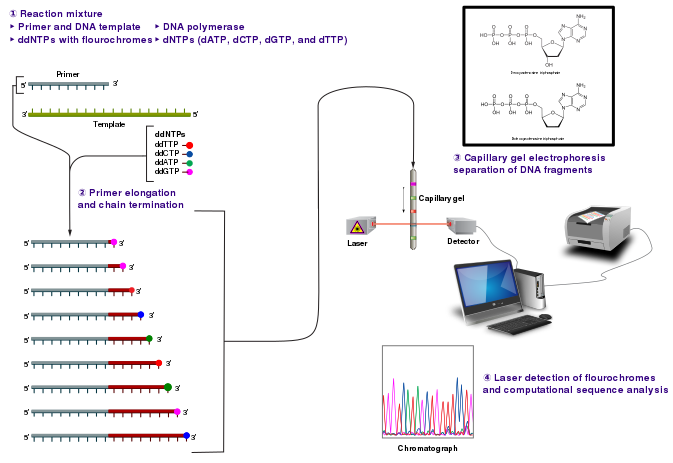
ddNTPs - ტერმინირებადი ნუკლეოტიდები გამოირჩევა ერთი 3'-OH - ჰიდროქსილის ჯგუფის ნაკლებობით, რომელიც აუცილებელია ნუკლეოტიდებს შორის ფოსფოდიესთერული ბმების წარმოსაქმნელად. სწორედ ამიტომ, ddNTP - ის ჩართვისას სინთეზირებად ჯაჭვში, აღარ ხდება შემდგომი ნუკლეოტიდების დაკავშირება და პოლიმერიზაციის პროცესი ჩერდება. დი-დეოქსინუკლეოტიდფოსფატები შესაძლოა მონიშნული იყოს რადიოაქტიურად ან ფლუორესცენტულად, რაც მათ დეტექციას უზრუნველყოფს.
დნმ-ის ნიმუში გაყოფილია 4 ცალკეულ სექვენირების რეაქციად, რომელთაგან თითოეული შეიცავს ოთხივე სტანდარტულ დეოქსინუკლეოტიდებს (dATP, dGTP, dCTP and dTTP) და დნმ-პოლიმერაზას. თითოეულ რეაქციაში ასევე დამატებულია 4 ტიპის დი-დეოქსინუკლეოტიდიდან ერთი - ddATP, ddGTP, ddCTP, ან ddTTP. დი-დეოქსინუკლეოტიდების კონცენტრაცია დაახლოებით 100-ჯერ უფრო დაბალი უნდა იყოს, ვიდრე შესაბამისი დეოქსინუკლეოტიდის კონცენტრაცია (მაგ. 0.005mM ddTTP : 0.5mM dTTP). ეს აუცილებელია იმისთვის, რომ შესაძლებელი გახდეს საკმარისი რაოდენობის ფრაგმენტების სინთეზი, ვიდრე ტრანსკრიბირდება სრული თანმიმდევრობა.
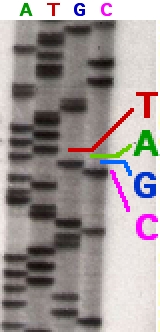
რეაქციის მიმდინარეობისას, პრაიმერის დაკავშირებისა და დნმ-ის თანმიმდევრობის სინთეზის შედეგად მიიღება დნმ-ის სხვადასხვა სიგრძის ფრაგმენტები, რომლებიც შემგომ დენატურირდება და ხორციელდება მათი სეპარაცია ზომების მიხედვით გელ-ელექტროფორეზში. დნმ-ის ბენდების ვიზუალიზაცია ხორციელდება აუტორადიოგრაფიულად ან UV - სხივების საშუალებით. დნმ-ის თანმიმდევრობის წაკითხვა შესაძლებელია X-ray - ფირიდან, ან გელის სურათიდან.
X-ray - ფირი, რომელიც ნაჩვენებია ფოტოზე (მარჯვნივ) წარმოდგენილია გელში და მუქი ბენდები შეესაბამება დნმ-ის სხვადასხვა სიგრძის მონაკვეთებს. გასწვრივად განლაგებული მუქი ბენდები გამოავლენს დნმ-ის ფრაგმენტებს, რომლებიც ჯაჭვის სინთეზისას მასში დი-დეოქსინუკლეოტიდის ჩართვისა (ddATP, ddGTP, ddCTP, ან ddTTP) და ტერმინაციის შედეგად არის მიღებული. სხვადასხვა ბენდის განსხვავებული პოზიცია ოთხივე ზოლში (ქვემოდან ზემო მიმართულებით) გამოიყენება დნმ-ის თანმიმდევრობის წასაკითხად.
ჯაჭვის-ტერმინაციით მიმდინარე სექვენირების ტექნიკური ვარიაციები მოიცავს ნუკლეოტიდების მონიშვნას რადიოაქტიური ფოსფორით (radiolabelling), ან პრაიმერების მონიშვნას 5' ბოლოებზე ფლუორესცენტული საღებავით. საღებავ-პრაიმერის გამოყენება სექვენირების შედეგების წაკითხვას ამარტივებს ოპტიკური სისტემების გამოყენებით, რაც სისწრაფით და ეკონომიურობითაც გამოირჩევა. ამასთან, რეაქციაში ფლუორესცენტულად მონიშნული დი-დეოქსინუკლეოტიდების გამოყენება, საერთო ჯამში ავტომატიზებული, მაღალი წარმადობის დნმ-სექვენირების შესაძლებლობებს ქმნის.
ჯაჭვის ტერმინაციაზე დაფუძნებულმა მეთოდებმა მნიშვნელოვნად გაამარტივა დნმ-ის სექვენირება. მაგალითად, აღნიშნულ მიდგომაზე დაყრდნობით შექმნილია კომერციულად ხელმისაწვდომი ნაკრებები, რომლებიც მოიცავს სექვენირებისთვის საჭირო ყველა კომპონენტს ალიქვოტირებული და გამოყენებისთვის მზა ფორმით. მეთოდის შეზღუდვებს შორის შეიძლება აღინიშნოს პრაიმერების არასპეციფიკური დაკავშირება დნმ-თან და დნმ-ის მეორეული სტრუქტურები, რომელთა მიერ შესაძლოა დნმ-ის თანმიმდევრობის წაკითხვის სიზუსტე შემცირდეს.
საღებავით ტერმინირებადი სექვენირებისას გამოიყენება ddNTP-ების მონიშვნა საღებავით, რაც საშუალებას იძლევა ოთხის ნაცვლად ერთი რეაქციის ფარგლებში განხორციელდეს სექვენირება. ამ შემთხვევაში ოთხი დი-დეოქსინუკლეოტიდიდან თითოეული მონიშნულია განსხვავებული ტალღის სიგრძის მქონე ფლუორესცენტული საღებავით. ოპტიმალურობისა და მაღალი სისწრაფის გამო, საღებავით ტერმინირებადი სექვენირება დღესდღეობით ავტომატიზებული სექვენირებისას გამოყენებულ ძირითად მეთოდს წარმოადგენს.
ავტომატიზება და ნიმუშების მომზადება
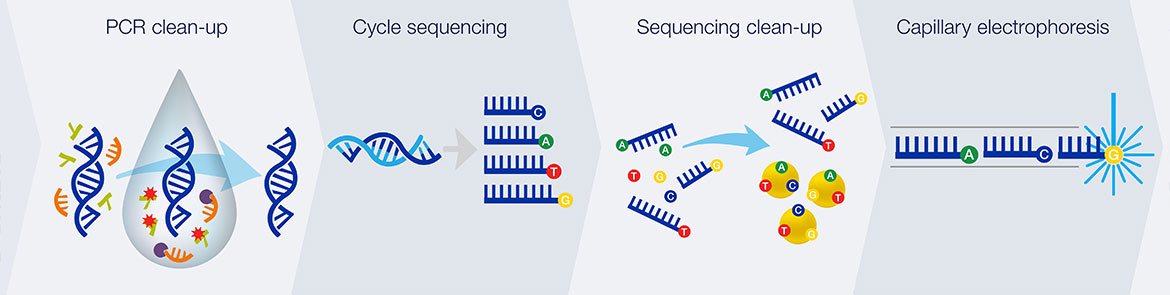
ავტომატიზებულ დნმ-სექვენირების ინსტრუმენტებს (დნმ-სექვენატორები) შესაძლებლობა აქვს ერთდროულად განახორციელოს 384 დნმ-ნიმუშის სექვენირება. თითოეული რეაქცია დღეში შესაძლოა 24-ჯერ შესრულდეს. დნმ-სექვენატორები დნმ-ის ფრაგმენტების სეპარაციას ახდენენ სიგრძის მიხედვით, კაპილარული ელექტროფორეზის გამოყენებით. მათ მიერ ასევე ხორციელდება ფლუორესცენციის დეტექცია და ჩაწერა, რის შედეგადაც მიიღება ფლუორესცენტული პიკების თანმიმდევრობა - ქრომატოგრამა. სექვენირების რეაქციები (თერმოციკლირება და მონიშვნა), ნიმუშების გაწმენდა და რე-სუსპენდირება ბუფერულ ხსნარში არის ის ეტაპები, რომლებიც ხორციელდება დამოუკიდებლად, ვიდრე ნიმუშების შეტანა მოხდება სექვენატორში. დღესდღეობით ხელმისაწვდომია მთელი რიგი კომერციული და არაკომერციული კომპიუტერული პროგრამები, რომელთა დახმარებით შესაძლებელია დაბალი ხარისხის ფლუორესცენტული სიგნალისგან (პიკები) შედეგების გაწმენდა. ამავე ფუნქციის შესრულება ვიზუალური შესწავლის შედეგად მეთოდოლოგიის მცოდნე ოპერატორსაც შეუძლია, თუმცა პროგრამული უზრუნველყოფა მნიშვნელოვანია დიდი მასშტაბის მონაცემებზე მუშაობისთვის.
მიკროფლუიდური სანგერის სექვენირება
მიკროფლუიდური სანგერის სექვენირება წარმოადგენს დნმ-ის სექვენირების ჩიპებზე დაფუძნებულ ტექნიკას, რომლის დროსაც სანგერის სექვენირების ეტაპები (თერმოციკლირება, ნიმუშების გაწმენდა და კაპილარული ელექტროფორეზი), გაერთიანებულია ერთ ჩიპში (a wafer-scale chip) და სარეაქციოდ ნიმუშები გამოიყენება ნანოლიტრების მოცულობებით. აღნიშნული ტექნოლოგია გენერირებს გრძელ და ზუსტ სექვენს-რიდებს, რაც ავტომატიზების დამსახურებაა. ამასთან, თავიდან არის აცილებული სანგერის სექვენირების კლასიკური მეთოდოლოგიის ისეთი ნაკლოვანებები, როგორიცაა: მაღალი ფასის მქონე რეაგენტების ხარჯვა დიდი ოდენობით, ასევე მაღალი ფასის მქონე აპარატურის აუცილებლობა და ოპერატორების მიერ რთული და ხანგრძლივი პროცედურების შესრულების საჭიროება.
თანამედროვე მეთოდოლოგიის მიხედვით, მაღალი წარმადობის გენომური სექვენირება მოიცავს გენომის ფრაგმენტირებას მცირე ზომის ერთ-ჯაჭვიან მონაკვეთებად, რასაც მოყვება მათი ამპლიფიკაცია პოლიმერაზული ჯაჭცური რეაქციის საშუალებით (პჯრ). სანგერის პრინციპის მიხედვით, თითოეული დნმ-ის ფრაგმენტის სინთეზი შეუქცევად ტერმინაციას განიცდის მას შემდეგ რაც მას დი-დექოსინუკლეოტიდი დაუკავშირდება. დიდექოსინუკლეოტიდების რეაქციაში ჩართვის შემთხვევითი ხასიათიდან გამომდინარე, მიიღება სხვადასხვა სიგრძის ფრაგმენტების “კიბე”, რომელთა სეპარაცია სიგრძის მიხედვით ხდება კაპილარულ ელექტროფორეზში (CAE). მიღებული ურთიერთგადამფარავი (სიგრძის მიხედვით დალაგებული) სექვენს-რიდები შემდგომ ეტაპზე კომპიუტერულად იწყობა და მიიღება ე.წ. “კონტიგები”, რომელთა ერთიანობა საბოლოო ჯამში გვაძლევს ჩვენთვის საინტერესო გენომური მონაკვეთის სრულ თანმიმდევრობას.
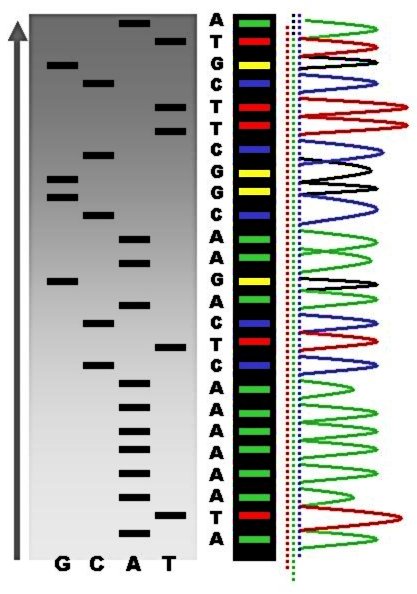
რადიოაქტიური სექვენირების შედეგების შედარება ფლუორესცენტულ პიკებთან
სანგერის სექვენირების შედეგად მიღებული რიდების სიგრძე დაახლოებით 800 აზოტოვან ფუძეს (bp) აღწევს (ტიპიურად - 500-600 bp). რიდების შედარებით გრძელი მონაკვეთები სანგერის მეთოდის უპირატესობას წარმოადგენს, განსაკუთრებით ისეთ შემთხვევებში, როდესაც საჭიროა გენომში არსებული განმეორებადი მონაკვეთების წაკითხვა. მოკლე რიდების პრობლემური მხარე მეტად აქტუალურია გენომის de novo სექვენირებისას, სიმსივნეების კვლევისას, ქრომოსომათა ისეთი მონაკვეთების შესწავლისას, სადაც აღინიშნება სტრუქტურული ვარიაციები.
სანგერის სექვენირების გამოყენების ასევე მნიშვნელოვან მიმართულებებს წარმოადგენს ერთ-ნუკლეოტიდური პოლიმორფიზმის (SNP) დეტექცია, ერთ-ჯაჭვიანი კონფორმაციების პოლიმორფიზმის (SSCP) ჰეტეროდუპლექსური ანალიზი და გენომის მოკლე ტანდემური განმეორებების (STR) შესწავლა. დნმ-ის ფრაგმენტების სხვადასხვა ზომის და კონფორმაციის მიხედვით დაყოფა წარმოადგენს ყველაზე კრიტიკულ საკითხს გენომის ჩამოთვლილი მახასიათებლების შესწავლისას.
სექვენირების პროტოკოლი მოიცავს 3 ძირითად ეტაპს:
- თერმოციკლირება (TC), რომელიც მიმდინარეობს სარეაქციო არეში არსებული ტერმინატორი-საღებავის, მატრიცული დნმ-ის, დნმ-პოლიმერაზას და პრაიმერების მეშვეობით. ეტაპი მოიცავს 35 ციკლს (95 °C-12 წამი და 60 °C – 55 წამი).
- პურიფიკაცია - გულისხმობს სარეაქციო არეში არსებული მიქსტურის (შეიცავს დნმ-მატრიცას, სინთეზირებულ ფრაგმენტებს, შესაბამის რეაგენტს) გაწმენდას არასასურველი მოლეკულებისგან. აღნიშნული ეტაპი ხორციელდება 30 °C-ზე, ელექტრონულ ველში - 33-ვოლტი/სმ, რომლის დროსაც გამოიყენება შემავალი და გამომავალი პორტები. გელი, რომლის გასწვრივაც ნიმუშში არსებული ფრაგმენტები მოძრაობს, შეიცავს 40 μM ოლიგონუკლეოტიდებს, რომლებიც პრაიმერების კომპლემენტარულია და კოვალენტურად არის დაკავშირებული პოლიაკრილამიდის მატრიქსთან. სინთეზირებული ფრაგმენტები იმობილიზდება გელის მატრიქსში და ზედმეტი პრაიმერები, მატრიცები, თავისუფალი ნუკლეოტიდები და მარილები რჩება “დამჭერ” (capture) გელში, რომელიც 67-75°C -ზე გაცხელებისას დნმ-ის სინთეზირებული ფრაგმენტების გამონთავისფლების საშუალებას იძლევა.
- კაპილარული ელოექტროფორეზი - სინთეზირებული ფრაგმენტების გაშვება კაპილარულ ელექტროფორეზში ხორციელდება 125-167-V/cm ელექტრულ ველში.
- შედეგების ანალიზი.
|
SeqStudio გენეტიკური ანალიზატორისთვის საჭირო რეაგენტებისა და სახარჯი მასალების ჩამონათვალი
|
|
|
კატ. N |
დასახელება |
|
A33671 |
კარტრიჯი |
|
A33401 |
SEQSTUDIO - კათოდური ბუფერის კონტეინერი |
|
A35640 |
CE რეზერვუარის სეპტა |
|
A35641 |
96-ფოსოიანი სეპტა SeqStudio™ გენეტიკური ანალიზატორისთვის |
|
A35641 |
CE პლანშეტი 96 ფოსოთი |
|
4337455 |
BDT V3.1 RR-100 და სექვენირების ბუფერი |
|
4336697 |
TUBE-5X SEQ ბუფერი 1 მლ |
|
4311320 |
HI-DI ფორმამიდი (ბოთლი) |
|
4376486 |
BIGDYE XTERMINATOR ნაკრები 2მლ |
|
3500 გენეტიკური ანალიზატორისთვის საჭირო რეაგენტებისა და სახარჯი მასალების ჩამონათვალი
|
|
|
კატ. N |
დასახელება |
|
4404685 |
კაპილარი - 8 კაპილარიანი სისტემა 50 სმ |
|
4393708 |
POP-7 (384) პოლიმერი 3500CE |
|
4393927 |
ანოდური ბუფერის კონტეინტერი 3500 სერიის გენეტიკური ანალიზატორებისთვის |
|
4408256 |
კათოდური ბუფერის კონტეინერი 3500 სერიის გენეტიკური ანალიზატორებისთვის |
|
4393718 |
ბუფერული რეაგენტი 3500 სერიის გენეტიკური ანალიზატორებისთვის |
|
4410715 |
სეპტა კათოდური ბუფერის კონტეინერისთვის (3500 სერიის გენეტიკური ანალიზატორებისთვის) |
|
4412614 |
96-ფოსოიანი სეპტა გენეტიკური ანალიზატორებისთვის |
|
A35641 |
CE Pპლანშეტი 96 ფოსოთი |
|
4337455 |
BDT V3.1 RR-100 და სექვენირების ბუფერი |
|
4336697 |
TUBE-5X SEQ ბუფერი 1 მლ |
|
4311320 |
HI-DI ფორმამიდი (ბოთლი) |
|
4376486 |
BIGDYE XTERMINATOR ნაკრები 2მლ |
